
新抗生素Emblaveo于欧盟获全球首批 辉瑞的抗生素组合Emblaveo已获得欧盟委员会的上市许可,成为了欧盟今年批准的第二种抗···
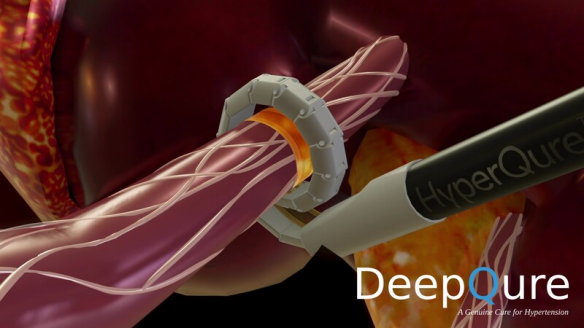
DeepQure获得FDA IDE批准治疗难治性高血压 DeepQure是一家总部位于首尔的医疗器械公司,该公司拥有一种用于肾去神经 (RDN) 的新型···

Adcomm一致投票支持礼来阿尔茨海默病治疗药物D 周一,FDA 外周和中枢神经系统药物咨询委员会以 11 票对 0 票一致通过了礼来公司的阿尔···

光化性角化病药物Klisyri在美获准将治疗面积扩大 微管抑制剂软膏Klisyri是一种局部外用的光化性角化病治疗药物,最初于2020年12月获得美···

FDA 批准 2 款新型 OTC 连续血糖监测仪 医疗技术公司雅培在一份新闻稿中宣布,FDA 已批准两款非处方 (OTC) 连续血糖监测 (CGM···

首创端粒酶抑制剂!RYTELO获批用于骨髓增生异常 生物制药公司Geron的药物RYTELO现已获得美国食品药品监督管理局(FDA)批准用于治疗骨···

英国MHRA批准四剂量Mounjaro“KwikPen”用于糖尿病 英国药监机构(MHRA)已批准糖尿病和体重管理药物Mounjaro(tirzepatide)的四剂版本(涵···

首个针对肺动脉高压根本病因药物:WINREVAIR在美 肺动脉高压是一种导致肺部和心脏问题恶化并最终危及生命的疾病,目前可以通过缓解症状···

首创AKT抑制剂Truqap联合用药在美获批! 现在这类型乳腺癌迎来了一种针对AKT基因改变的新的靶向疗法,在内分泌治疗中出现进展或···

FDA 批准 Wegovy 用于降低超重和肥胖患者的心血管 2024年4月17日讯 /香港登越药业Dengyue/ --索马鲁肽(Wegovy)的一项新适应症已获得 F···

FDA 批准 Lisocabtagene Maraleucel 用于治疗复发或难治【香港登越药业】 香港登越药业讯:Lisocabtagene maraleucel(Breyanzi;liso-cel)已获得 FDA 的加速批···

FDA 批准Nivolumab加化疗治疗不可切除或转移性尿路【香港登越药业】 香港登越药业讯:FDA批准了第一个同时免疫疗法-化疗组合,用于成人不可切除或转移性尿···